диффузное
давление, термодинамический параметр, характеризующий стремление раствора к понижению концентрации при соприкосновении с чистым растворителем вследствие встречной диффузии молекул растворённого вещества и растворителя. Если раствор отделен от чистого растворителя полупроницаемой мембраной, то возможна лишь односторонняя диффузия -
осмотическое всасывание растворителя через мембрану в раствор. В этом случае О. д. становится доступной для прямого измерения величиной, равной избыточному давлению, приложенному со стороны раствора при осмотическом равновесии (см.
Осмос). О. д. обусловлено понижением химического потенциала (См.
Химический потенциал) растворителя в присутствии растворённого вещества. Тенденция системы выравнивать химические потенциалы во всех частях своего объёма и перейти в состояние с более низким уровнем свободной энергии (См.
Свободная энергия) вызывает
осмотическое (диффузионный) перенос вещества. О. д. в идеальных и предельно разбавленных растворах не зависит от природы растворителя и растворённых веществ; при постоянной температуре оно определяется только числом "кинетических элементов" - ионов, молекул, ассоциатов или коллоидных частиц - в единице объёма раствора. Первые измерения О. д. произвёл В.
Пфеффер (1877), исследуя водные растворы тростникового сахара. Его данные позволили Я. X.
Вант-Гоффу установить (1887) зависимость О. д. от концентрации растворённого вещества, совпадающую по форме с
Бойля - Мариотта законом для идеальных газов. Оказалось, что О. д. (p) численно равно давлению, которое оказало бы растворённое вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объём, равный объёму раствора. Для весьма разбавленных растворов недиссоциирующих веществ найденная закономерность с достаточной точностью описывается уравнением: πV =
nRT, где
n - число молей растворённого вещества в объёме раствора
V; R - универсальная газовая постоянная;
Т - абсолютная температура. В случае диссоциации вещества в растворе на ионы в правую часть уравнения вводится множитель
i > 1, коэффициент Вант-Гоффа; при ассоциации растворённого вещества
i < 1. О. д. реального раствора (π') всегда выше, чем идеального (π''), причём отношение π'/ π'' =
g, называемое осмотическим коэффициентом, увеличивается с ростом концентрации. Растворы с одинаковым О. д. называется изотоническими или изоосмотическими. Так, различные кровезаменители и физиологические растворы изотоничны относительно внутренних жидкостей организма. Если один раствор в сравнении с другим имеет более высокое О. д., его называют гипертоническим, а имеющий более низкое О. д. - гипотоническим.
О. д. измеряют с помощью специальных приборов - осмометров. Различают статические и динамические методы измерения. Первый метод основан на определении избыточного гидростатического давления по высоте столба жидкости Н в трубке осмометров (
рис.) после установления осмотического равновесия при равенстве внешних давлений
pA и
рБ в камерах А и Б. Второй метод сводится к измерению скоростей v всасывания и выдавливания растворителя из осмотической ячейки при различных значениях избыточного давления Δ
p =
pA -
рБ с последующей интерполяцией полученных данных к ν = 0 при Δ
p = π. Многие осмометры позволяют использовать оба метода. Одна из главных трудностей в измерении О. д. - правильный подбор полупроницаемых мембран. Обычно применяют плёнки из целлофана, природных и синтетических полимеров, пористые керамические и стеклянные перегородки. Учение о методах и технике измерения О. д. называются осмометрией. Основное приложение осмометрии - определение молекулярной массы (
М) полимеров. Значения М вычисляют из соотношения
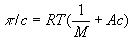
, где
с - концентрация полимера по массе;
А - коэффициент, зависящий от строения макромолекулы.
О. д. может достигать значительных величин. Например, 4\%-ный раствор сахара при комнатной температуре имеет О. д. около 0,3 Мн/м2, а 53\%-ный - около 10 Мн/м2; О. д. морской воды около 0,27 Мн/м2.
Л. А. Шиц.
О. д. в клетках животных, растений, микроорганизмов и в биологических жидкостях зависит от концентрации веществ, растворённых в их жидких средах. Солевой состав биологических жидкостей и клеток, характерный для организмов каждого вида, поддерживается избирательной проницаемостью биологических мембран (См.
Проницаемость биологических мембран) для разных солей и активным транспортом ионов. Относительное постоянство О. д. обеспечивается водно-солевым обменом (См.
Водно-солевой обмен), т. е. всасыванием, распределением, потреблением и выделением воды и солей (см.
Выделение,
Выделительная система,
Осморегуляция). У т. н. гиперосмотических организмов внутреннего О. д. больше внешнего, у гипоосмотических - меньше внешнего; у изоосмотических (пойкилоосмотических) внутреннее О. д. равно внешнему. В первом случае ноны активно поглощаются организмом и задерживаются в нём, а вода поступает через биологич. мембраны пассивно, в соответствии с осмотическим градиентом. Гиперосмотическая регуляция свойственна пресноводным организмам, мор. хрящевым рыбам (акулы, скаты) и всем растениям. У организмов с гипоосмотической регуляцией имеются приспособления для активного выделения солей. У костистых рыб преобладающие в океанических водах ионы Na
+ и Cl
- выделяются через жабры, у морских пресмыкающихся (змеи и черепахи) и у птиц - через особые солевые железы, расположенные в области головы. Ионы Mg
2+,
SO42-,
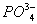
у этих организмов выделяются через почки. О. д. у гипер- и гипоосмотических организмов может создаваться как за счёт ионов, преобладающих во внешней среде, так и продуктов обмена. Например, у акуловых рыб и скатов О. д. на 60\% создаётся за счёт мочевины и триметиламмония; в плазме крови млекопитающих - главным образом за счёт ионов Na
+ и Cl
-; в личинках насекомых - за счёт разнообразных низкомолекулярных метаболитов. У морских одноклеточных, иглокожих, головоногих моллюсков, миксин и др. изоосмотических организмов, у которых О. д. определяется О. д. внешней среды и равно ему, механизмы осморегуляции отсутствуют (исключая клеточные).
Диапазон средних величин О. д. в клетках организмов, не способных поддерживать осмотический
Гомеостаз, довольно широк и зависит от вида и возраста организма, типа клеток и О. д. окружающей среды. В оптимальных условиях О. д. клеточного сока наземных органов болотных растений колеблется от 2 до 16
ат, у степных - от 8 до 40
ат. В разных клетках растения О. д. может резко различаться (так, у мангровых О. д. клеточного сока около 60
ат, а О. д. в сосудах ксилемы не превышает 1-2
ат). У гомойосмотических организмов, т. е. способных поддерживать относительное постоянство О. д., средней величины и диапазон колебаний О. д. различны (дождевой червь - 3,6-4,8
ат, пресноводные рыбы - 6,0-6,6, океанические костистые рыбы - 7,8-8,5, акуловые - 22,3-23,2, млекопитающие - 6,6-8,0
ат). У млекопитающих О. д. большинства биологических жидкостей равно О. д. крови (исключение составляют жидкости, выделяемые некоторыми железами, - слюна, пот, моча и др.). О. д., создаваемое в клетках животных высокомолекулярными соединениями (белки, полисахариды и др.), незначительно, но играет важную роль в обмене веществ (см.
Онкотическое давление).
Ю. В. Наточин, В. В. Кабанов.
Лит.: Мелвин-Хьюз Э. А., Физическая химия, пер. с англ., кн. 1-2, М., 1962; Курс физической химии, под ред. Я. И. Герасимова, т. 1-2, М. - Л., 1963-1966; Пасынский А. Г., Коллоидная химия, 3 изд., М., 1968: Проссер Л., Браун Ф., Сравнительная физиология животных, пер. с англ., М., 1967; Гриффин Д., Новик Эл., Живой организм, пер. с англ., 1973; Нобел П., Физиология растительной клетки (физико-химический подход), пер. с англ., М., 1973.
Принципиальная схема осмометра: А - камера для раствора; Б - камера для растворителя; М - мембрана. Уровни жидкости в трубках при осмотическом равновесии: а и б - в условиях равенства внешних давлений в камерах А и Б, когда ρА = ρБ, при этом Н - столб жидкости, уравновешивающий осмотическое давление; б - в условиях неравенства внешних давлений, когда ρА - ρБ = π.

